
近日,由北京大学肿瘤医院沈琳教授团队主导的KRAS G12C抑制剂戈来雷塞治疗KRAS G12C突变晚期结直肠癌(CRC)的的两项I/II期临床研究合并分析结果,在国际顶级医学期刊《柳叶刀·胃肠病学和肝脏病学》(The Lancet Gastroenterology & Hepatology IF 38.6)正式发表。该研究聚焦KRAS G12C抑制剂戈来雷塞联合或不联合西妥昔单抗治疗在晚期结直肠癌(CRC)患者中的疗效与安全性,为这一难治性患者群体提供了新的治疗方向。

(原文标题:戈来雷塞联合或不联合西妥昔单抗治疗既往经治KRAS G12C突变的局部晚期或转移性结直肠癌(JAB-21822-1002及JAB-21822-1007研究):两项开放性、非随机I/II期临床试验)
戈来雷塞(艾瑞凯®)于今年5月22日获得国家药品监督管理局批准上市,用于至少接受过一种系统性治疗的KRAS G12C突变型晚期非小细胞肺癌(NSCLC)成人患者,疗效和安全性优秀 ,并且是目前国内已获批的KRAS G12C抑制剂中唯一实现每日单次口服给药的药物,艾瑞凯®提供了更加高效便捷的治疗方案,重塑了KRAS G12C突变型患者治疗格局。
研究背景
结直肠癌(CRC)是全球第三大常见恶性肿瘤,在癌症相关死亡率中位列第二。KRAS是CRC中最常发生突变的癌基因之一,突变发生率约为40%,其中KRAS G12C突变约占4%。传统化疗及部分靶向治疗效果有限,临床存在显著未满足需求。
本研究旨在探索戈来雷塞在KRAS G12C突变晚期结直肠癌患者中的疗效,评估其单药或联合西妥昔单抗的治疗潜力。
核心数据发布
本研究报告了在I-II期开放标签、非随机临床试验的数据,研究共纳入90例的KRAS G12C突变晚期结直肠癌(CRC)患者,其中44例接受戈来雷塞单药治疗(800 mg QD),46例接受戈来雷塞联合西妥昔单抗治疗。(西妥昔单抗给药方式:每周给药,按体表面积计算剂量,首剂400 mg/m²,后续以250 mg/m²维持;或按每两周500 mg/m²给药)。主要终点为客观缓解率(ORR)。
l 疗效数据:
单药组客观缓解率(ORR)为22.7%,疾病控制率(DCR)达86.4%;联合治疗组ORR为50.0%,DCR为87.0%。单药组中位无进展生存期(PFS)为5.6个月,中位总生存期(OS)为16.0个月,联合组中位PFS及中位OS分别为6.9个月,19.3个月。
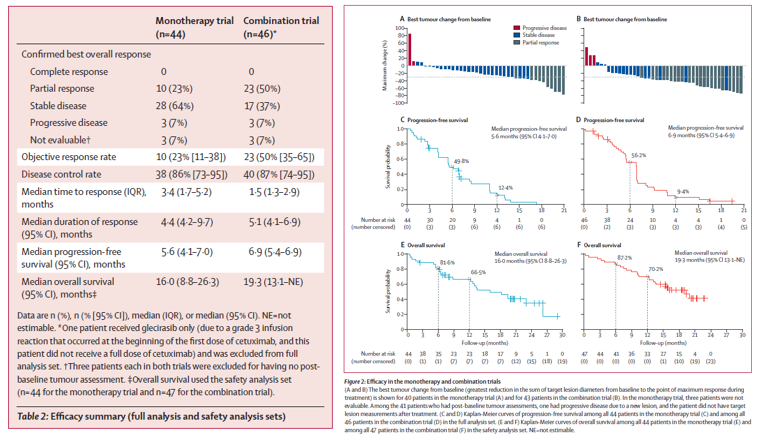
l 安全性数据:
单药组未出现4级或5级治疗相关不良事件,联合组发生2例4级治疗相关不良事件,分别为血胆固醇升高(1例)和电解质紊乱(1例),未出现5级治疗相关不良事件。单药及联合组≥3级治疗相关不良事件发生率分别为20.5%和19.1%,整体安全性可控。
研究意义
作为艾力斯又一款获批上市的创新药,戈来雷塞单药或联合西妥昔单抗在携带KRAS G12C突变的晚期难治性CRC患者中显示出了初步疗效,且安全可控。此次研究数据支持其进一步探索在结直肠癌及其他实体瘤中的应用潜力,为戈来雷塞在更多适应症中的开发奠定坚实基础,助力构建更加完善的KRAS G12C突变癌症治疗体系。
关于艾瑞凯®
2024年8月,艾力斯与加科思药业(1167.HK)签订许可协议,获得KRAS G12C靶向药物戈来雷塞及SHP2抑制剂(AST24082、JAB-3312)在中国(包括中国大陆、香港、澳门及台湾)的独家开发和商业化权利。戈来雷塞是一款KRAS G12C抑制剂,目前已在中国、美国及欧洲多国启动多项针对晚期实体瘤患者的临床试验,包括与SHP2抑制剂AST 24082联用治疗非小细胞肺癌,与西妥昔单抗在结直肠癌的联合用药,以及多瘤种注册临床研究。其中,胰腺癌适应症在美国和欧洲获得孤儿药认定,并在中国被纳入突破性治疗药物认定程序。戈来雷塞于2025年5月22日在国内获批上市,商品名为艾瑞凯®。
关于艾力斯
上海艾力斯医药科技股份有限公司成立于2004年3月,是一家以全球医药市场需求为导向,专注于肿瘤治疗领域,集新药研发、生产和商业化为一体的创新型制药企业。艾力斯医药以科技关爱生命为发展理念,以开发首创药物和同类最佳药物为首要目标。历经20多年坚持不懈的努力,艾力斯已经成功自主研发,获批多款创新药,具备持续创制具有自主产权的、疗效确切的抗肿瘤新药之综合实力。2020年12月2日,上海艾力斯医药科技股份有限公司正式在上海证券交易所科创板挂牌上市(股票代码:688578)。
上海艾力斯医药科技股份有限公司(以下简称"本公司")郑重提示
本微信公众号所有内容(包括但不限于文字、图片、视频等)旨在分享学术前沿资讯、提供本公司及其子公司的相关信息,该等资讯及信息仅供医疗卫生专业人士参阅,不构成对任何药品或诊疗方案的推荐或广告宣传,也不构成本公司的信息披露或投资推荐。本公司不推荐任何未获批药品使用和/或未获批适应症用药,亦不对任何药品和/或适应症作推荐。相关药品或医疗信息请以国家批准的药品说明书或正规医学指南为准。

